Dari cacing gelang hingga manusia, pemberian sinyal melalui keluarga reseptor protein Notch mendorong perkembangan embrio, diferensiasi sel, dan homeostasis jaringan. Hal ini juga sangat penting untuk transformasi sel kekebalan manusia yang belum matang menjadi sel T – pejuang seluler yang menargetkan virus dan tumor.
Namun aktivasi sinyal Notch sulit ditiru di laboratorium, sehingga hampir mustahil untuk dieksploitasi di klinik dan menghambat upaya untuk menghasilkan terapi sel T. Namun hal itu bisa saja berubah.
Pada bulan Juli, peserta konferensi di Lewiston, Maine, yang didedikasikan untuk pensinyalan Notch disuguhi bukan hanya satu, tetapi dua alat baru untuk mengaktifkan jalur tersebut. Tanpa sepengetahuan satu sama lain, dua kelompok penelitian telah bekerja secara paralel untuk mengembangkan apa yang mereka ungkapkan pada konferensi tersebut.
“Ini adalah titik balik,” kata Juan Carlos Zúñiga-Pflücker, ahli imunologi perkembangan di Universitas Toronto di Kanada, yang laboratoriumnya telah memelopori banyak teknik aktivasi Notch. Baginya, pengumuman tersebut mewakili “kemunculan kembali” pekerjaan ini di bidang Notch.
Masalah dengan 2D
Kebanyakan reseptor mengalami semacam perubahan konformasi setelah berikatan dengan ligannya, yang mengarah pada rangkaian peristiwa yang mengubah perilaku sel. Namun pengikatan ligan saja tidak cukup untuk mengaktifkan Notch.
Setelah reseptor berikatan dengan ligannya (yang ditambatkan ke sel lain), sel pengekspres ligan tergulung dalam kompleks reseptor ligan. Seperti menarik benang lepas pada sweter, gaya tarik yang dihasilkan akan mengurai sebagian reseptor Notch, memaparkannya pada enzim yang melepaskan domain intraseluler reseptor dan memungkinkannya melakukan perjalanan ke nukleus untuk memengaruhi ekspresi gen.
Sel induk tersembunyi untuk mengobati penyakit
“Tantangan teknologi sebenarnya adalah menghasilkan obat yang dapat meniru efek menarik tersebut,” kata Vincent Luca, seorang insinyur protein di Moffitt Cancer Center di Tampa, Florida.
Strategi saat ini memerlukan kultur sel yang mengekspresikan reseptor Notch dengan sel yang mengekspresikan ligan, atau memasang ligan pada pelat atau manik. Namun metode ‘2D’ ini tidak dapat digunakan secara alamikata Luka.
Hal ini juga merupakan penghambat produksi sel T skala besar, kata George Daley, ahli hematologi dan biologi sel induk di Harvard Medical School di Boston, Massachusetts, karena hanya sel pada antarmuka penyaji ligan tersebut yang dapat diaktifkan. Selama bertahun-tahun, laboratorium Daley telah berjuang dengan keterbatasan metode 2D sambil mencoba membujuk sel induk berpotensi majemuk menjadi sel T.
Pada tahun 2021, Daley didekati oleh Rubul Mout, yang saat itu merupakan peneliti pascadoktoral di Universitas Washington di Seattle di laboratorium David Baker, yang memenangkan Hadiah Nobel Kimia tahun 2024 atas karyanya dalam desain protein berbantuan komputer. Mout ingin menerapkan teknik desain tersebut pada sistem berbasis sel induk Daley.
Daley “sangat bersemangat” dengan gagasan tersebut, dan bahkan sebelum Mout secara resmi bergabung dengan labnya, mereka mendiskusikan rekayasa agonis Notch yang dapat larut – yang dapat menghadirkan ligan Notch ke sel dalam suspensi, bukan pada permukaan datar.
Sel CAR-T dengan turbocharger melelehkan tumor pada tikus — menggunakan trik dari sel kanker
Dengan menggunakan alat desain protein Rosetta yang dikembangkan di laboratorium Baker, Daley, Mout dan rekan mereka merancang agonis potensial dengan menempelkan banyak salinan ligan ke perancah protein. Mereka bereksperimen dengan desain dengan sedikitnya dua dan sebanyak 120 salinan ligan, serta geometri yang berbeda.
Satu pengaturan bekerja dengan sangat baik: tiga salinan ligan memancar keluar dari perancah, seperti jari-jari. Ketika ditambahkan ke sel pengekspres Notch dalam suspensi, ligan multivalen ini menghubungkan sel-sel tersebut secara mikroskopis pas de deuxdengan masing-masing sel T yang berkembang dengan lembut menarik (dan mengaktifkan) sel lainnya. Dibandingkan dengan aktivasi 2D, aktivasi Notch menggunakan agonis terlarut dalam bioreaktor menghasilkan sel T lima kali lebih banyak per mikrogram agonis.1menunjukkan bahwa pendekatan ini mungkin berguna untuk pembuatan sel T skala besar.
Meningkatkan Takik
Luca mengatakan bahwa kelompoknya, sebaliknya, sedang mencari “cara yang tepat sasaran dan terfokus untuk mengaktifkan Notch”, dengan tujuan terapi. Misalnya, meningkatkan Notch dapat meremajakan sel T yang kelelahan dan mencoba menghancurkan tumor – namun hal ini harus dilakukan tanpa mengaktifkan sel tumor, yang juga mengekspresikan Notch.
Laboratorium Luca menghasilkan SNAG, agonis Notch sintetik (lihat ‘Meniru takik’), dengan menggabungkan gen agonis Notch dengan gen yang mengkode fragmen antibodi yang menargetkan sel kanker. Hasilnya mengkodekan protein bispesifik yang membentuk apa yang disebut Luca sebagai “jembatan molekuler kecil” antara sel yang mengekspresikan Notch dan sel yang mengekspresikan antigen kanker. Peristiwa pengikatan tersebut secara mekanis mengaktifkan reseptor dengan cara yang mirip dengan pensinyalan Notch alami2.
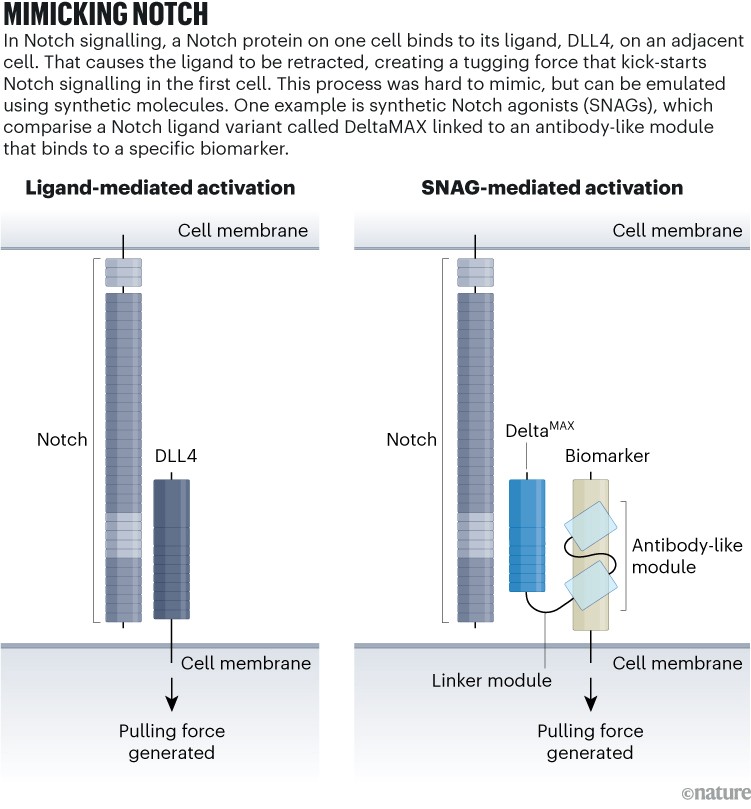
Sumber: Diadaptasi dari ref. 2
Agonis Notch terlarut yang sangat berbeda diluncurkan pada bulan Januari. Ahli biofisika Björn Högberg dan timnya di Institut Karolinska di Stockholm mempelajari interaksi yang sangat kecil dan taktil antara protein selama pemberian sinyal sel, yang oleh Högberg diibaratkan sebagai “sistem Braille” yang digunakan sel untuk berbicara satu sama lain.
Bekerja sama dengan Luca, tim menciptakan agonis protein-DNA hibrida dengan menempelkan beberapa salinan ligan Notch di sepanjang sepotong DNA yang telah dilipat, bergaya origami, ke dalam sebuah batang. Yang mengejutkan mereka, agonis tersebut mengaktifkan Notch tanpa menghasilkan gaya tarik yang dapat diukur3.
Para peneliti berpendapat bahwa agonis origami mereka mungkin memicu mekanisme aktivasi alternatif, di mana pengikatan ligan jangka panjang cukup untuk menyebabkan penguraian reseptor, meskipun dengan kecepatan yang jauh lebih lambat. Namun mereka masih mencoba memahami bagaimana hal ini bisa berhasil.
Kanker yang bermutasi tinggi memberikan respons yang lebih baik terhadap terapi kekebalan
Reaksi dari komunitas mengenai kemungkinan mekanisme aktivasi Notch yang bersifat pull-independen beragam, Högberg mengatakan: “Saya pikir beberapa dari mereka benar-benar tertarik dan benar-benar ingin tahu lebih banyak, dan beberapa dari mereka berkata, ‘Saya tidak tahu. menurutku ini bukan apa-apa.’”
Sementara itu, Zúñiga-Pflücker skeptis bahwa ligan origami bekerja tanpa gaya tarik apa pun. Namun “pekerjaannya telah diselesaikan dengan sangat baik”, katanya, seraya menambahkan bahwa “ketiga makalah tersebut cukup menarik dalam cara yang berbeda”.
Bahkan beberapa tahun yang lalu, kata Mout, de novo desain protein tidak cukup maju untuk mengatasi masalah biologi yang bermakna. Namun bidang ini berkembang pesat, katanya, dan masalah-masalah nyata sedang dipecahkan. “Semuanya menjadi satu sekarang,” katanya.




